Entdecken Sie die Vorteile und Lösungen der Endotoxin-Retention mit IV-Inline-Filtern
Es wird von den medizinischen und pharmazeutischen Behörden weltweit allgemein anerkannt, dass alle Produkte und Substanzen, die in den Blutkreislauf eines Patienten gelangen, frei von Endotoxinen oder „pyrogenfrei“ sein müssen, d. h., unabhängig vom Status des Patienten sollten sie vor exogenem Endotoxin geschützt werden.
Einführung & Herausforderungen
Die Funktion von Endotoxin in der Pathophysiologie der Sepsis wird seit dem Jahr 1800ern untersucht, als Endotoxin zum ersten Mal als gramnegatives Zellwandtoxin entdeckt wurde, das für einen tödlichen Schock verantwortlich ist.1 Heute ist die systemische gramnegative Sepsis mit Endotoxin als Hauptauslöser nach wie vor eine der schwerwiegendsten Erkrankungen, die den Krankheitsverlauf von Krankenhauspatienten kompliziert, vor allem bei kritisch kranken Patienten auf der Intensivstation (ICU).2,3
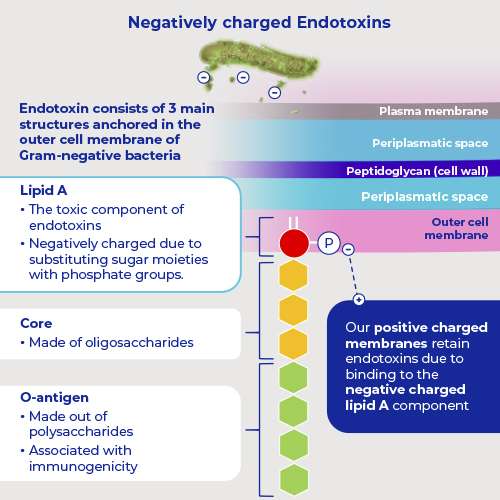
Die chemische Strukturanalyse hat gezeigt, dass eine Endotoxineinheit aus einer Lipid-A-Komponente und einer O-Antigen-Komponente besteht. Das O-Antigen besteht aus Polysacchariden und wird mit Immunogenität in Verbindung gebracht, während der Lipid-A-Anteil des Endotoxins die toxische Komponente darstellt.4 Die Reaktion des Immunsystems auf einen Lipid-A-Bestandteil kann zu einer schweren generalisierten Entzündung führen, die sich klinisch als septischer Schock mit multiplen Organfunktionsstörungen, insbesondere Herzmuskelschwäche und Nierenfunktionsstörungen, äußert.5Bei der Infusionstherapie können gramnegative Bakterien und das damit verbundene Endotoxin von außen in den Blutkreislauf des Patienten gelangen, beispielsweise durch kontaminierte Geräte oder Flüssigkeiten.6–13In der Vergangenheit wurden Krankenhausfälle untersucht, in denen Endotoxin in intravenösen Lösungen zu unerwünschten Reaktionen oder sogar zum Tod führte.14–19
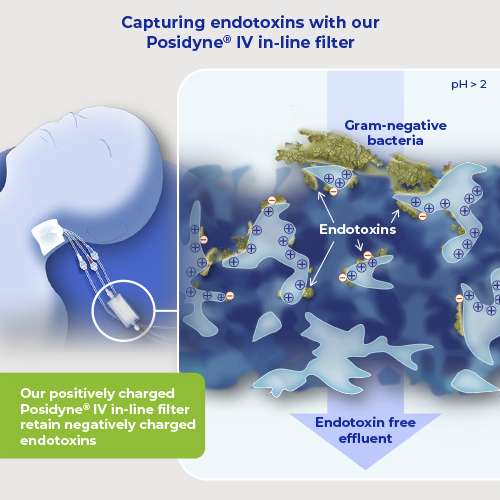
Hier kommen unsere Posidyne®-IV-Inline-Filter ins Spiel – diese halten Endotoxine zurück und verhindern, dass sie während der IV-Therapie in den Blutkreislauf des Patienten gelangen. Unsere Validierungstests über 96 Stunden haben bestätigt, dass
- Unsere ELD96 IV-Inline-Filter (gealtert und nicht gealtert) > 99,9999 % der Endotoxinbelastung zurückhielten, die durch die 1 x 108 E. coli-Belastung in 0,9 %iger Kochsalzlösung mit einer Ausflusskonzentration von < 0,1 EU/mL* bei einer durchschnittlichen Belastung von > 1 x 103 EU/cm2 ergab (* Nachweisgrenze des Tests = 0,1 EU/mL).20
- Unsere NEO96 IV-Inline-Filter (gealtert und nicht gealtert) hielten > 99,9999 % der Endotoxinbelastung zurück, die durch die 1 x 108 E. coli-Belastung in 0,9 %iger Kochsalzlösung mit einer Ausflusskonzentration von < 0,1 EU/mL* bei einer durchschnittlichen Belastung von > 1 x 104 EU/cm2 ergab (* Nachweisgrenze des Tests = 0,1 EU/mL).21
Wenn ein Patient bereits krank ist, einen septischen Schock oder eine andere kritische Erkrankung aufweist, machen dann ein paar Endotoxineinheiten wirklich einen Unterschied?
Ja, in Studien wurden die klinischen Auswirkungen selbst geringer Dosen von Endotoxinen auf den Menschen beschrieben.22,23
Ihre Vorteile mit unseren Posidyne-IV-Inline-Filtern
- Rückhaltung von Endotoxin bis zu 96 Stunden unter klinisch relevanten Bedingungen24–27
- Zeit- und Kostenersparnis für das Personal durch weniger IV-Filtersatzwechsel28–30
- Verbesserung der klinischen Ergebnisse32–36
Wir sind der führende Pionier und stellen seit über vier Jahrzehnten positiv geladene, membranbasierte IV-Inline-Filterprodukte mit dem Anspruch der Entfernung von Bakterien und den damit verbundenen Endotoxinen für das Gesundheitswesen her.
Referenzen
- Romaschin A.D., Klein D.J., Marshall JC. (2012). Bench-to-bedside review: Clinical experience with the endotoxin activity assay. Crit Care; 16 (6): 248
- Sakr Y, Jaschinski U, Wittebole X, et al. (2018). Sepsis in Intensive Care Unit Patients: Worldwide Data From the Intensive Care over Nations Audit. Open Forum Infect Dis;5 (12): 1–9
- Ianaro A, Tersigni M, D'Acquisto F. (2009) New insight in LPS antagonist. Mini Rev Med Chem; 9 (3):306–17.
- Sampath VP. (2018). Bacterial endotoxin-lipopolysaccharide; structure, function and its role in immunity in vertebrates and invertebrates. Agriculture and Natural Resources; 52 (2): 115–120
- Virzì G.M. et al. (2017). Endotoxin Effects on Cardiac and Renal Functions and Cardiorenal Syndromes. Blood Purif; 44: 314–326
- Twum-Danso K, Dawodu AH, Saleh M.A.F., Makiling L.S. (1989). An out-break of K. pneumoniae bacteremia in five children on intravenous therapy. J. Hosp. Infest; 14: 271–274.
- Ng P.C. et al. (1989). An outbreak of Acinetobacter septicaemia in a neonatal intensive care unit. Journal of Hospital Infection, 14: 363–368
- Lacey S. und Want S.V. (1991). Pseudomonas pickettii infections in a paediatric oncology unit. Journal of Hospital Infection; 17 (1): 45–51
- Ezzedine H. et al. (1994). An outbreak of Ochrobactrum anthropi bacteremia in five organ transplant patients. J Hosp Infect; 27: 35–42
- J.A.Frean, Arntzen L., Rosekilly I., Isaäcson M. (1994). Investigation of contaminated parenteral nutrition fluids associated with an outbreak of Serratia odorifera septicaemia. Journal of Hospital Infection; 27 (4): 263–273
- Bernards A.T. et al. (1997). Outbreak of septicaemia in neonates caused by Acinetobacter junii investigated by amplified ribosomal DNA restriction analysis (ARDRA) and four typing methods. Journal of Hospital Infection; 35 (2): 129–140
- Garland S.M. et al. (1996). Pseudomonas aeruginosa outbreak associated with a contaminated blood-gas analyser in a neonatal intensive care unit. Journal of Hospital Infection, 33: 145–151
- Holmes C.J. et al. (1980). Potential Hazards Associated with Microbial Contamination of In-Line Filters During Intravenous Therapy. Journal of Clinical Microbiology; 12 (6): 725–7:31
- Garrett D.O. et al. (2002). An Outbreak of Neonatal Deaths in Brazil Associated with Contaminated Intravenous Fluids. The Journal of Infectious Diseases; 186 (1): 81–86
- Daufenbach, L. (2006). Pyrogenic Reactions and Hemorrhage Associated With Intrinsic Exposure to Endotoxin-Contaminated Intravenous Solutions. Infection Control & Hospital Epidemiology; 27 (7): 735–741
- Schroeder J. et al. (2015). Practically Saline. Journal of Investigative Medicine High Impact Case Reports; 1–4
- CDC (1998). Endotoxin-Like Reactions Associated with Intravenous Gentamicin -- California, 1998. Entnommen von: https://www.cdc.gov/mmwr/preview/mmwrhtml/00055322.htm
- Johnstone T. et al. (2018). Seven cases of probable endotoxin poisoning related to contaminated glutathione infusions. Epidemiol Infect. 2018;146(7):931–934. doi:10,1017/S0950268818000420
- Patel AS, et al. (2006) Outbreak of systemic inflammatory response syndrome linked to a compounding pharmacy – Virginia, 2005 In. 55. Annual Epidemic Intelligence Service Conference. Atlanta, Georgia, USA: U.S. Department of Health and Human Services.
- Ragunath S. und Spiers S. (2021). Evaluation of endotoxin retention efficiency of Pall ELD96 IV filters with 0,2 µm Posidyne® membrane over a 96–hour period; Pall Technical Report
- Ragunath S. und Spiers S. (2021). Evaluation of endotoxin retention efficiency of Pall NEO96 IV filters with 0,2 µm Posidyne® membrane over a 96–hour period; Pall Technical Report
- Suffredini A.F., Hochstein H.D., McMahon F.G. (1999). Dose-related inflammatory effects of intravenous endotoxin in humans: evaluation of a new clinical lot of Escherichia coli O:113 endotoxin. J Infect Dis; 179 (5): 1278–82
- Bahador M., Cross A.S. (2007). From therapy to experimental model: a hundred years of endotoxin administration to human subjects. Journal of Endotoxin Research; 13 (5): 251–279
- Baumgartner, T. G. et al. (1986). Bacterial endotoxin retention by inline intravenous filters. Am. J Hosp. Pharm; 43:681–684
- Horibe, K. et al. (1990). Evaluation of the endotoxin retention capabilities of inline intravenous filters. JPEN J. Parenter. Enteral. Nutr; 14: 56–59
- Richards, C. & Grassby P. F. (1994). A comparison of the endotoxin-retentive abilities of two ‘96–h’ in-line intravenous filters. J. Clin. Pharm. Ther; 19 (3): 199–202
- Spielberg, R. und J. Martin. 1985. Evaluation of the endotoxin/bacterial retention of I.V. filters during simulated extended infusions, p. 1001. In Technical note IV. Pall Biomedical Ltd., Portsmouth, United Kingdom.
- Villa G et al. (2020). In-line filtration reduced phlebitis associated with peripheral venous cannulation: Focus on cost-effectiveness and patients' perspectives. J Vasc Access; 21(2): 154–160
- Van den Hoogen A. et al. (2006). In-line filters in central venous catheters in a neonatal intensive care unit. J Perinat Med; 34(1): 71–4
- Van Lingen et al. (2004). The use of in-line intravenous filters in sick newborn infants. Acta Paediatr; 93(5): 658–62
- Unger-Hunt L. (2019). Reducing Risks and Generating Economic Benefits. Health Management; 19 (4): 286–287
- Jack T. et al. (2012). In-line filtration reduces severe complications and length of stay on pediatric intensive care unit: a prospective, randomized, controlled trial. Intensive Care Med; 38(6): 1008–16
- Boehne M. et al. (2013). In-line filtration minimizes organ dysfunction: New aspects from a prospective, randomized, controlled trial. BMC Pediatrics; 13 (21): 1–8
- Sasse M. et al. (2015). In-line Filtration Decreases Systemic Inflammatory Response Syndrome, Renal and Hematologic Dysfunction in Pediatric Cardiac Intensive Care Patients. Pediatr Cardiol; 36: 1270–1278
- Villa G et al. (2018). In-Line Filtration Reduces Postoperative Venous Peripheral Phlebitis Associated With Cannulation: A Randomized Clinical Trial. Anesth Analg; 127(6): 1367–1374
- Virlouvet A.L. et al. (2020). In-line filtration in very preterm neonates: a randomized controlled trial. Scientific Reports; 10 (5003): 1–8
Im Jahr 1892 prägte Richard Pfeiffer, ein deutscher Arzt und Bakteriologe, der zusammen mit Robert Koch am Institut für Infektionskrankheiten in Berlin arbeitete, den Begriff „Endotoxin“. und beschrieb das Konzept, dass toxische Bakterien auf einen Faktor zurückzuführen sind, der von lysierten Bakterien freigesetzt wird. Im Rahmen dieser Forschung formulierte Richard Pfeiffer das Konzept des „Endotoxins als ein Gift, das während des mikrobiellen Lebens fest an die Bakterienzelle gebunden ist und erst post mortem freigesetzt wird, um eine krankmachende Wirkung zu entfalte.“
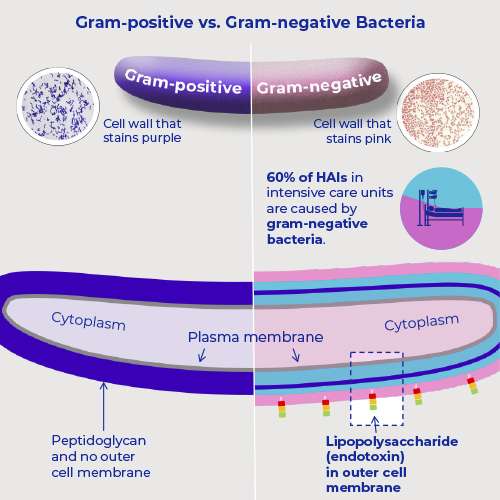
Heute ist ein Endotoxin definiert als eine toxische, hitzestabile Lipopolysaccharid-Substanz, die in der äußeren Membran gramnegativer Bakterien vorhanden ist und bei der Lyse aus der Zelle freigesetzt wird.2 Daher wird ein Endotoxin auch als Lipopolysaccharid oder LPS bezeichnet. Im Gegensatz zu gramnegativen Bakterien produzieren grampositive Bakterien kein Endotoxin, da diese Bakterien keine äußere Zellmembran besitzen. Die chemische Strukturanalyse ergab, dass eine Endotoxineinheit aus folgenden Bestandteilen
- Fett (bekannt als Lipid A) und
- Kohlenhydraten (Polysacchariden) besteht.
Der Lipid-A-Anteil des Endotoxins ist die toxische Komponente, während das O-Antigen aus Polysacchariden besteht und mit Immunogenität in Verbindung gebracht wird.3
Referenzen
- Rietschel E. T. und Cavaillon J.M. (2002). Endotoxin and anti-endotoxin: The contribution of the schools of Koch and Pasteur: Life, milestone-experiments and concepts of Richard Pfeiffer (Berlin) and Alexandre Besredka (Paris). Journal of Endotoxin Research; 8 (2): 71–82
- Merriam-Webster (2021, August 18). Endotoxin. Aus den https://www.merriam-webster.com/dictionary/endotoxin
- Sampath VP. (2018). Bacterial endotoxin-lipopolysaccharide; structure, function and its role in immunity in vertebrates and invertebrates. Agriculture and Natural Resources; 52 (2): 115–120
Krankenhausassoziierte Infektionen und Endotoxin produzierende gramnegative Bakterien
Daten zwischen 2008 und 2018 geht hervor, dass nach Schätzungen der Centers for Disease Control (CDC) allein in amerikanischen Krankenhäusern jedes Jahr schätzungsweise 1,7 Millionen Infektionen und 98.000 damit verbundene Todesfälle auf krankenhausassoziierte Infektionen (HAI – Hospital-Associated Infections) zurückzuführen sind.1,2 Fast ein Drittel aller HAI und 60 % der HAI auf Intensivstationen werden durch gramnegative Bakterien verursacht.3 Darüber hinaus gehören gramnegative Bakterien aufgrund der hohen Resistenz gegen Antibiotika zu den größten Problemen der öffentlichen Gesundheit weltweit.4 Zu den gramnegativen Infektionen gehören solche, die durch Klebsiella, Acinetobacter, Pseudomonas aeruginosa und E. coli verursacht werden, sowie viele andere weniger verbreitete Bakterien.4
Referenzen
- Haque M, Sartelli M, McKimm J, Abu Bakar M. (2018). Health care-associated infections - An Overview. Infect Drug Resist;11:2321–2333.
- Agarwal M., Shiau S., Larson E.L. (2008). Repeat gram-negative hospital-acquired infections and antibiotic susceptibility: A systematic review. Journal of Infection and Public Health; 11(4): 455–462
- Oliveira J, Reygaert WC. Gram Negative Bacteria. [Aktualisiert 2021 Mar29]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan. Erhältlich von: https://www.ncbi.nlm.nih.gov/books/NBK538213/
- CDC [Aktualisiert 2011 January17]. Gram-negative Bacteria Infections in Healthcare Settings. Erhältlich von: https://www.cdc.gov/hai/organisms/gram-negative-bacteria.html
Schon geringe Dosen von Endotoxin führen beim Menschen zu klinischen Auswirkungen
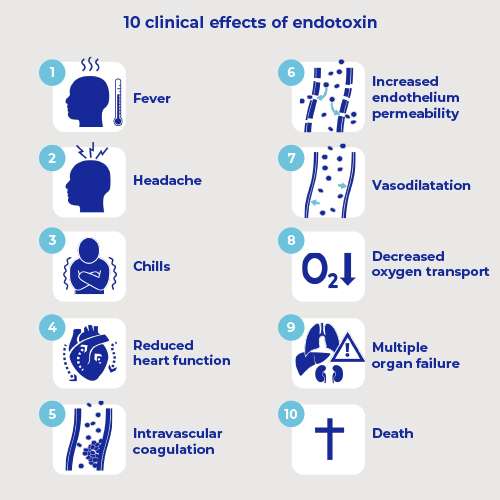
Zu den klinischen Folgen von Endotoxinen gehören1,2
- Fieber, Kopfschmerzen, Schüttelfrost
- verminderte Herzfunktion (kardiale Kontraktilität), was zu Tachykardie führt, um den Kreislauf in Gang zu halten
- intravaskuläre Gerinnung, die zu Gefäßverschlüssen führt (Blockierung des Kreislaufs)
- Erweiterung der Blutgefäße (Vasodilatation), die einen Blutdruckabfall (Hypotonie) verursacht
- Schädigung der Auskleidung der Blutgefäße (erhöhte Permeabilität des Endothels), was zum Austritt von Flüssigkeit aus dem Blutgefäß in das umliegende Gewebe führt (Ödeme)
- verminderter Sauerstofftransport zu den Geweben (verminderte Durchblutung)
- im schlimmsten Fall ist das Herz nicht mehr in der Lage, das Blut durch das System zu pumpen, der Blutdruck fällt ab, große Teile des Kreislaufs werden nicht erreicht, insbesondere in den Organen, die einen hohen Blutdurchsatz benötigen, und die Gewebe werden nicht ausreichend mit Sauerstoff versorgt.
Infolgedessen kann es zu einem fortschreitenden Funktionsverlust von Nieren, Lunge, Herz und Gehirn kommen, der zu einem Multiorganversagen führt, das tödlich sein kann.
In Studien wurden die Auswirkungen selbst geringer Dosen von Endotoxin auf den Menschen beschrieben. In Experimenten an gesunden Freiwilligen wurden schädliche Wirkungen bei der Verwendung von 2–4 ng Endotoxin pro Kilogramm Körpergewicht festgestellt. Dies entspricht bis 20–40 Endotoxineinheiten (EU – Endotoxin Units) pro kg. Bei dieser Konzentration traten bei den Probanden Fieber, eine erhöhte Herzfrequenz, Kopfschmerzen, Schüttelfrost und Gliederschmerzen auf, und es wurden eine deutlich verringerte Herzfunktion, ein erhöhter Blutdruck, eine erhöhte Anzahl weißer Blutkörperchen und Entzündungsfaktoren, eine erhöhte Darmdurchlässigkeit und eine Aktivierung des Gerinnungssystems festgestellt.3–10
Referenzen
- Glauser M.P., Zanetti G., Baumgartner J.D., Cohen J. (1991). Septischer Schock: Pathogenese. Lancet; 338 (8769): 732–6
- Balk R.A. (1994). Septischer Schock: Pathophysiologie. Current Opinion in Anesthesiology; 7(2): 136–140
- Fullerton J.N. et al. (2016). Intravenöse Endotoxinbelastung bei gesunden Menschen: Eine experimentelle Plattform zur Untersuchung und Modulation systemischer Entzündungen. J Vis Exp; (111): 53913
- Calvano SE, Coyle SM. (2012): Experimental human endotoxemia: a model of the systemic inflammatory response syndrome? Surgical infections;13(5): 293–299
- Bahador M., Cross A.S. (2007). From therapy to experimental model: a hundred years of endotoxin administration to human subjects. Journal of Endotoxin Research; 13 (5): 251–279
- Suffredini A.F., Hochstein H.D., McMahon F.G. (1999). Dose-related inflammatory effects of intravenous endotoxin in humans: evaluation of a new clinical lot of Escherichia coli O:113 endotoxin. J Infect Dis; 179 (5): 1278–82
- Suffredini A.F. et al. (1989). The Cardiovascular Response of Normal Humans to the Administration of Endotoxin. N Engl J Med; 321: 280–287
- Casale TB et al. (1990). The effects of intravenous andutoxin on various host-effector molecules. J Allergy Clinical Immunology; 85: 45–51
- Suffredini A.F., Harpel P.C., Parrillo J.E. (1989). Promotion and Subsequent Inhibition of Plasminogen Activation after Administration of Intravenous Endotoxin to Normal Subjects. N Engl J Med; 320: 1165–1172
- Gralnick H.R. et al. (1989). Von Willebrand factor release induced by endotoxin. J Laboratory Clinical Medicine; 113 (1): 118–122
Ja, der Endotoxin-Grenzwert für ein Produkt ist die Endotoxin-Konzentration, die nicht erreicht oder überschritten werden darf, um das Produkt zum Verkauf freizugeben. Für parenterale Arzneimittel lautet die in der United States Pharmacopeia (USP) <85> angegebene Endotoxin-Grenzwertgleichung wie folgt:1,2
Endotoxin-Grenzwert = K/M
K = 5 EU/kg Körpergewicht für jeden parenteralen Verabreichungsweg außer der intrathekalen Verabreichung; ist dies die pyrogene Schwellendosis von Endotoxin pro kg Körpergewicht.
M = die maximale empfohlene Bolusdosis des Arzneimittels pro kg Körpergewicht – bei kontinuierlicher Infusion, M = die maximale Gesamtdosis, die in einem Zeitraum von einer Stunde verabreicht wird
Beispiel
Auf der Grundlage eines 70 kg-Patienten wäre der Endotoxin-Grenzwert 350 EU, d. h., für einen 2 mL-Bolus müsste das Arzneimittel weniger als 175 EU/mL der Lösung enthalten, und für 1 L eines intravenös über eine Stunde verabreichten Arzneimittels müsste es weniger als 0,35 EU/mL der Lösung enthalten.
Für ein Medikament, das als 2 mL Bolus an einen 10 kg schweren Patienten verabreicht wird, müsste es weniger als 25 EU/mL aufweisen.
Wie wird bei Infusionslösungen auf Endotoxin getestet?
Beim Limulus-Amöbozyten-Lysat-Test (LAL) wird ein Extrakt aus dem Blut des Pfeilschwanzkrebses verwendet, das in Gegenwart von Endotoxin schnell gerinnt. Der LAL-Test wird seit ~30 Jahren zum Nachweis von Endotoxin bei der Qualitätssicherung von injizierbaren Arzneimitteln und Medizinprodukten eingesetzt.3
Referenzen
- Dawson M. (2017). ENDOTOXIN LIMITS For Parenteral Drug Products. BET White Paper; 1 (2): 1–7
- USP [Aktualisiert 2017 February25]. <85> Bacterial Endotoxins. Erhältlich von: https://www.usp.org/harmonization-standards/pdg/general-methods/bacterial-endotoxins
- Ding J.L. & Ho B. (2010). Endotoxin detection - from limulus amebocyte lysate to recombinant factor C. Subcell Biochem; 53: 187–208
Das Risiko: Die Endotoxinbildung in intravenösen Lösungen erfolgt innerhalb von 24 Stunden
Frühere Studien haben gezeigt, dass sich gramnegative Bakterien in intravenösen Lösungen vermehren und Endotoxine absondern können.1–3 Die versehentliche Infusion von unsterilen, mit Endotoxinen kontaminierten Flüssigkeiten ist zwar selten, doch wurden Fälle von Endotoxinen in intravenösen Lösungen, die zu unerwünschten Reaktionen oder sogar zum Tode führten, in Krankenhäusern untersucht.4–9
Unser Test: Die Anreicherung von Endotoxin in Infusionslösungen
Wir haben die Konzentration von E.coli und die entsprechenden Endotoxinwerte über einen Zeitraum von 96–hour überwacht, wenn ein 1-Liter-Behälter mit 0,9 %iger Kochsalzlösung oder 1 Liter AKE 1100 mit Xylit (Fresenius Kabi) mit 1 x 108 KBE E.coli kontaminiert war.
Die nachstehende Tabelle zeigt die E.coli-Konzentration (KBE/mL), die in den Lösungen zum Zeitpunkt 0 und nach 96-stündiger Lagerung bei Raumtemperatur nachgewiesen wurde (interne Daten).Während die Endotoxineinheiten / mL in der Kochsalzlösung über 96 Stunden relativ konstant blieben, stiegen die Endotoxineinheiten / mL in der parenteralen Ernährungslösung nach Stunden um etwa
- um einen Faktor 10 nach 24 Stunden,
- um einen Faktor 100 nach 48 Stunden,
- um einen Faktor 1.000 nach 72 Stunden,
- und nach Stunden um einen Faktor > 1.000 nach 96 Stunden (über dem Grenzwert des Tests).
| (A) Durchschnittliche Gesamtzahl (KBE/mL) bei T(0h) und T(96h) | |||||
|---|---|---|---|---|---|
| Zeit (h) | 0 | 24 | 48 | 72 | 96 |
| Mittlere Anzahl von Bakterien in 0,9 %iger Kochsalzlösung | 9,14 x 103 | N. z. | N. z. | N. z. | 1,62 x 102 |
| Mittlere Anzahl von Bakterien in AKE 1100 | 9,14 x 103 | N. z. | N. z. | N. z. | 5,20 x 107 |
| (B) Endotoxin-Konzentration (EU/mL) über die Zeit | |||||
| Zeit (h) | 0 | 24 | 48 | 72 | 96 |
| Endotoxin-Einheiten in 0,9 %iger Kochsalzlösung | 1,54 | 1,54 | 1,22 | 2,2 | 0,91 |
| Endotoxin-Einheiten in AKE 1100 | 1,5 | 13,2 | 95,6 | 1,75 x 103 | >5,00 x 103 |
Referenzen
- Holmes C.J. et al. (1980). Potential Hazards Associated with Microbial Contamination of In-Line Filters During Intravenous Therapy. Journal of Clinical Microbiology; 12 (6): 725–731
- Trautmann M. et al. (1997). Bacterial colonization and endotoxin contamination of intravenous infusion fluids. J Hosp Infect; 37(3): 225–36
- Jorgensen J.H. und Smith R.F. (1973). Rapid detection of contaminated intravenous fluids using the Limulus in vitro endotoxin assay. Appl Microbiol; 26 (4): 521–524
- Garrett D.O. et al. (2002). An Outbreak of Neonatal Deaths in Brazil Associated with Contaminated Intravenous Fluids. The Journal of Infectious Diseases; 186 (1): 81–86
- Daufenbach, L. (2006). Pyrogenic Reactions and Hemorrhage Associated With Intrinsic Exposure to Endotoxin-Contaminated Intravenous Solutions. Infection Control & Hospital Epidemiology; 27 (7): 735–741
- Schroeder J. et al. (2015). Practically Saline. Journal of Investigative Medicine High Impact Case Reports; 1–4
- CDC (1998). Endotoxin-Like Reactions Associated with Intravenous Gentamicin -- California, 1998. Entnommen von: https://www.cdc.gov/mmwr/preview/mmwrhtml/00055322.htm
- Johnstone T. et al. (2018). Seven cases of probable endotoxin poisoning related to contaminated glutathione infusions. Epidemiol Infect. 2018;146(7):931–934. doi:10,1017/S0950268818000420
- Patel AS, et al. (2006) Outbreak of systemic inflammatory response syndrome linked to a compounding pharmacy – Virginia, 2005 In. 55. Annual Epidemic Intelligence Service
Das Problem: IV-Inline-Filter müssen wegen des Endotoxinrisikos alle 24 Stunden gewechselt werden.
Viele Lösungen werden über längere Zeiträume als 24 Stunden verabreicht. Sollte ein klinisch tätiger Arzt Bedenken haben, ob IV-Inline-Filter in Bezug auf Endotoxine sicher sind?
Ja. Eine In-vitro-Studie von Holmes et al. simulierte das Wachstum von Bakterien während einer simulierten Infusion und untersuchte ungeladene 0,22 µm-IV-Inline-Filter im Hinblick auf deren Fähigkeit, Bakterien (R. agglomerans, S. marcescens, K. pneumoniae und P. aeruginosa) und das damit verbundene Endotoxin über einen 72–hour Zeitraum zurückzuhalten.1
Die Studie zeigte, dass sich die gramnegativen Bakterien zwar in den Lösungen auf der Anströmseite der IV-Inline-Filter vermehrten, aber keiner der 0,22 µm-IV-Inline-Filter den Durchgang der Bakterien auf die Reinseite über den 72–hour Zeitraum zuließ. Bei allen verwendeten 4 gramnegativen Bakterien wurde jedoch Endotoxin auf der Reinseite der IV-Inline-Filter zwischen 24 und 48 Stunden nachgewiesen, was zu der Schlussfolgerung führte, dass „zur Vermeidung dieser potenziellen Gefahr der terminalen Filtration die Inline-Filter-Sätze alle 24 Stunden gewechselt werden sollten.“
Auf der anderen Seite führt der Wechsel des IV-Leitungsfilters alle 24 Stunde zu erheblichen Kosten, Personalaufwand und Manipulationen am Gerät mit den damit verbundenen Risiken einer bakteriellen Kontamination.2–7 Die Verlängerung der Nutzungsdauer des IV-Inline-Verabreichungssets mit einem Endotoxin-retentierenden Filter kann zu erheblichen Kosten- und Zeiteinsparungen führen und das Risiko einer bakteriellen Kontamination durch weniger Manipulationen an den IV-Leitungen potenziell minimieren.8
Referenzen
- Holmes C.J. et al. (1980). Potential Hazards Associated with Microbial Contamination of In-Line Filters During Intravenous Therapy. Journal of Clinical Microbiology; 12 (6): 725–731
- Stromberg G, Wahlgren J. (1989). Saving money with effective inline filters. Intens Care Nurs; 5 (109)
- Barber N, Jacklin A. (1987). CCU drug costs—the pharmacists’ role. Int Care World; 4 (80)
- Ballard K. (1990)Showing where the money goes: cost-effective care in ICU. Prof Nurse: 565
- Clarke R. (1990). A cost-effective system for TPN. Nurs Times; 86: 65
- Puntis JWL, Booth IW. (1990). The place of a nutritional care team in paediatric parctice. Intens Ther Clin Monitor; 11 (132)
- Cousins D. (1988). Cost savings in IV therapy. Care Crit Ill; 4 (1)
- Bethune K. et al. (2001). British Pharmaceutical Nutrition Group Working Party. Use of Filters During the Preparation and Administration of Parenteral Nutrition: Position Paper and Guidelines Prepared by a British Pharmaceutical Nutrition Group Working Party. Nutrition; 17 (5): 403–8
Die Lösung: Verlängerung des Einsatzes von IV-Inline-Filtern auf bis zu 96 Stunden
Es wäre vernünftig zu erwarten, dass jeder IV-Inline-Filter, der für eine Verwendung über 24 Stunden in einer Infusionsleitung vorgesehen ist, validiert wird, um zu zeigen, dass er Endotoxine in Infusionsleitungen zurückhält. Mehrere Studien haben die Endotoxin-Retentionseigenschaften von 0,2 µm-Filtern während simulierter klinischer Infusionen untersucht. Diese Studien haben gezeigt, dass es deutliche Unterschiede in der Fähigkeit gibt, Endotoxine unter diesen Testbedingungen zurückzuhalten.1–4
Wir stellen seit mehr als vier Jahrzehnten positiv geladene, membranbasierte intravenöse Filterprodukte für das Gesundheitswesen her, die Bakterien und damit verbundene Endotoxine bis zu 96 Stunden zurückhalten können.
Das von der Zelle abgesonderte Endotoxin-Aggregat ist ein Partikel mit einer partiell stark negativen Ladung. Es ist möglich, diese Aggregate zurückzuhalten, indem eine positive Ladung in geeigneter Dichte und Konfiguration zur Oberfläche der Filtermembran orientiert wird. Die Zugabe einer partiell positiven Ladung garantiert nicht automatisch eine zuverlässige Endotoxinretention, weshalb umfangreiche Tests notwendig sind.
Endotoxine enthalten freiliegende Phosphatgruppen, die im Allgemeinen bei pH-Werten über pH 2 stark negativ geladen sind. Infusionslösungen haben einen höheren pH-Wert und unsere positiv geladenen Infusionsfilter bieten daher die Möglichkeit, die negativ geladenen Endotoxine zu entfernen.
Referenzen
- Baumgartner, T. G. et al. (1986). Bacterial endotoxin retention by inline intravenous filters. Am. J Hosp. Pharm; 43:681–684
- Horibe, K. et al. (1990). Evaluation of the endotoxin retention capabilities of inline intravenous filters. JPEN J. Parenter. Enteral. Nutr; 14: 56–59
- Richards, C. & Grassby P. F. (1994). A comparison of the endotoxin-retentive abilities of two ‘96–h’ in-line intravenous filters. J. Clin. Pharm. Ther; 19 (3): 199–202
- Spielberg, R. und J. Martin. (1985). Evaluation of the endotoxin/bacterial retention of I.V. filters during simulated extended infusions, p. 1001. In Technical note IV. Pall Biomedical Ltd., Portsmouth, United Kingdom.
Der Beweis: Unsere IV-Inline-Posidyne-Filter halten ungewollte Endotoxine bis zu 96 Stunden zurück.
Mehrere Veröffentlichungen der letzten 40 Jahre haben gezeigt, dass unsere IV-Inline-Filter mit Posidyne-Membran Endotoxine sowohl in klinischen als auch in Laborumgebungen zurückhalten.1–7
Darüber hinaus hat unser Wissenschafts- und Laborservice (SLS – Scientific Laboratory Services) unsere IV-Inline-Filter mit Posidyne-Membran mit E. coli, einem klinisch relevanten Organismus, der zur Bildung von Endotoxinen führen kann, getestet.
Unsere ELD96 und NEO96 Posidyne IV-Inline-Filter sind luftabscheidende Filter mit 0,2-µm-Posidyne-Membran, die bis zu bis zu 96 Stunden mit jedem Infusionsset verwendet werden und dient der Entfernung von partikulären Verunreinigungen, mikrobiellen Kontaminationen und den damit verbundenen Endotoxinen sowie von Lufteinschlüssen aus Lösungen, die zur intravenösen oder subkutanen Infusion verwendet werden.
Evaluation of endotoxin retention efficiency of our ELD96 IV filters with 0,2 µm Posidyne® membrane over a 96–hour period.
Unsere ELD96 Posidyne IV-Inline-Filter (gealtert und nicht gealtert) hielten > 99,9999 % der Endotoxinbelastung zurück, die durch die 1 x 108 E. coli-Belastung mit einer Ausflusskonzentration von < 0,1 EU/mL bei einer durchschnittlichen Belastung von > 1 x 103 EU/cm2 entstanden war.
Bewertung der Endotoxin-Retentionseffizienz unserer NEO96 IV-Filter mit 0,2-µm-Posidyne®-Membran über einen 96–hour-Zeitraum.
Unsere NEO96 Posidyne IV-Inline-Filter (gealtert und nicht gealtert) hielten > 99,9999 % der Endotoxinbelastung zurück, die durch die 1 x 108 E. coli-Belastung mit einer Ausflusskonzentration von < 0,1 EU/mL bei einer durchschnittlichen Belastung von > 1 x 104 EU/cm2 entstanden war.
Referenzen
- Baumgartner, T. G. et al. (1986). Bacterial endotoxin retention by inline intravenous filters. Am. J Hosp. Pharm; 43:681–684
- Horibe, K. et al. (1990). Evaluation of the endotoxin retention capabilities of inline intravenous filters. JPEN J. Parenter. Enteral. Nutr; 14: 56–59
- Richards, C. & Grassby P. F. (1994). A comparison of the endotoxin-retentive abilities of two ‘96–h’ in-line intravenous filters. J. Clin. Pharm. Ther; 19 (3): 199–202
- Richards C, Thomas P. (1990). Use of endotoxin retentive intravenous filters with pediatric total parenteral nutrition solutions. J Clin Pharm Ther;15(1): 53–8
- Vanhaecke E., De Muynck C., Remon J.P., Colardyn F. (1989). Endotoxin removal by end-line filters. J Clin Microbiol; 27(12):2710–2.
- Barnett M.L., Cosslett A.G. (1996). Endotoxin Retention Capabilities of Positively Charged Nylon and Positively Charged Polysulphone Membrane Intravenous Filters. Pharmacy and Pharmacology Communications; 2 (7): 319–320
- Ortolano G. et al. (2009). Bacterial Lipopolysaccharide Retention by a Positively Charged Filter. Applied and Environmental Microbiology 75 (4): 1219
Endotoxin kann durch gramnegative Bakterien, die sich auf einem nicht positiv geladenen IV-Filter festsetzen, oder durch eine externe Quelle, wie eine kontaminierte Ausrüstung oder IV-Flüssigkeiten, in den Blutkreislauf eines Intensivpatienten gelangen.
Verlängern Sie die Nutzungsdauer der IV-Inline-Filter von 24 Stunden auf 96 Stunden
Nur bei Endotoxine zurückhaltenden Infusionsfiltern ist der Einsatz über mehr als 24 Stunden sicher. Studien haben gezeigt, dass unsere Posidyne IV-Inline-Filter Endotoxine unter klinisch relevanten Bedingungen zurückhalten.1–4 Indem Sie die Dauer des IV-Inline-Filters auf 96 Stunden verlängern, verringert das Personal der Intensivstation das Risiko einer möglichen Kontamination.
Vorteile für Ihre Intensivpatienten
Several studies have described the clinical effects of even small doses of endotoxin on humans.5 Aber wenn ein Patient bereits krank ist, einen septischen Schock oder eine andere kritische Erkrankung aufweist, machen dann ein paar Endotoxineinheiten wirklich einen Unterschied?
Es wird von den medizinischen und pharmazeutischen Behörden weltweit allgemein anerkannt, dass alle Produkte und Substanzen, die in den Blutkreislauf eines Patienten gelangen, frei von Endotoxinen oder „pyrogenfrei“ sein müssen, d. h., unabhängig vom Status des Patienten sollten sie vor exogenem Endotoxin geschützt werden. Patienten mit Gerinnungsstörungen, Entzündungen oder Herzfunktionsstörungen würden von zusätzlichem Endotoxin nicht profitieren und es könnte eine zusätzliche Belastung darstellen.
Kosteneinsparungen für Ihr Krankenhaus
Mit dem Einsatz von 0,2 µm-Endotoxin-retentiven IV-Inline-Filtern können erhebliche Kosten- und Zeiteinsparungen erzielt werden, da die Nutzungsdauer von IV-Inline-Filtern und Infusionssets um bis zu 96 Stunden verlängert werden können. Jüngste Studien haben über das Ausmaß dieser Einsparungen berichtet.6–10
Referenzen
- Baumgartner, T. G. et al. (1986). Bacterial endotoxin retention by inline intravenous filters. Am. J Hosp. Pharm; 43:681–684
- Horibe, K. et al. (1990). Evaluation of the endotoxin retention capabilities of inline intravenous filters. JPEN J. Parenter. Enteral. Nutr; 14: 56–59
- Richards, C. & Grassby P. F. (1994). A comparison of the endotoxin-retentive abilities of two ‘96–h’ in-line intravenous filters. J. Clin. Pharm. Ther; 19 (3): 199–202
- Spielberg, R. und J. Martin. (1985). Evaluation of the endotoxin/bacterial retention of I.V. filters during simulated extended infusions, p. 1001. In Technical note IV. Pall Biomedical Ltd., Portsmouth, United Kingdom.
- Suffredini A.F., Hochstein H.D., McMahon F.G. (1999). Dose-related inflammatory effects of intravenous endotoxin in humans: evaluation of a new clinical lot of Escherichia coli O:113 endotoxin. J Infect Dis; 179 (5): 1278–82
- Villa G. et al. (2020). In-line filtration reduced phlebitis associated with peripheral venous cannulation: Focus on cost-effectiveness and patients' perspectives. J Vasc Access; 21(2): 154–160
- Van den Hoogen A. et al. (2006). In-line filters in central venous catheters in a neonatal intensive care unit. J Perinat Med; 34(1): 71–4
- Van Lingen et al. (2004). The use of in-line intravenous filters in sick newborn infants. Acta Paediatr; 93(5): 658–62
- Jack T. et al. (2012). In-line filtration reduces severe complications and length of stay on pediatric intensive care unit: a prospective, randomized, controlled trial. Intensive Care Med; 38(6): 1008–16
- Unger-Hunt L. (2019). Reducing Risks and Generating Economic Benefits. Health Management; 19 (4): 286–287
Unsere hochqualifizierten technischen Experten in unserem „Wissenschafts- und Laborservice“ (SLS – Scientific Laboratory Services) stehen Ihnen zur Seite und beraten Sie hinsichtlich optimaler intravenöser Filtrations- und Infusionslösungen oder zur Durchführung von Medikamenten-Verträglichkeitsstudien.
Unsere klinischen Spezialisten unterstützen Kunden, die Geräte von Pall zur intravenösen, Atemluft- und Gasfiltration einsetzen möchten. Sie implementieren und evaluieren unsere Produkte in Krankenhäusern am Patientenbett und beraten bei eventuell auftretenden Problemen.
Vielen Dank
Danke für Ihr Interesse. Wir werden uns bald bei Ihnen melden.